Horizon Taşıyıcılık Taraması Testi
Risk ne kadar erken öğrenilirse, o kadar iyi hazırlık yapılabilir ve kararlar alınabilir.
Horizon taşıyıcılık taraması, kişilere ebeveynlik yolculuklarının hangi noktasında olurlarsa olsunlar önemli genetik hastalıkları çocuklarına aktarma riskleri konusunda kritik bilgiler verir.

ACOG, tüm bireylere gebelik öncesinde veya gebelik sırasında taşıyıcılık taramasını önermektedir.
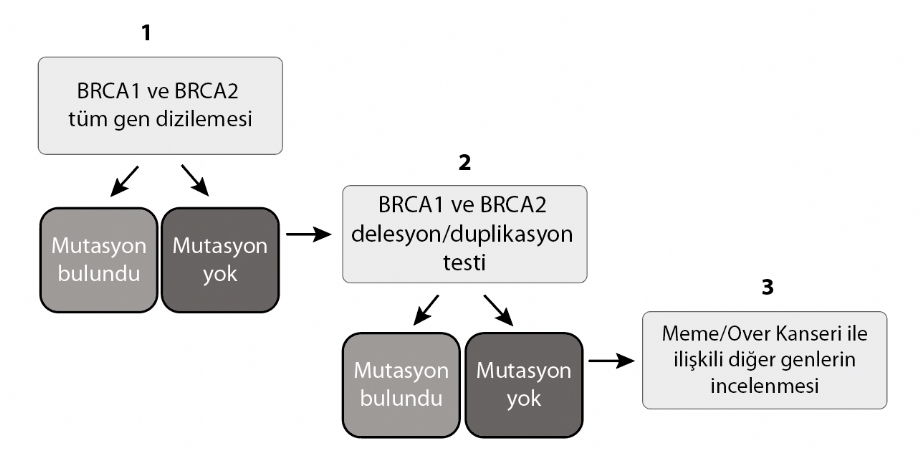
Aşağıdaki üç hastalığın tüm hastalar için taranması önerilmektedir.
• Kistik fibrozis (CF): Her 45 kişiden 1’i taşıyıcı
• Spinal musküler atrofi (SMA): Her 50 kişiden 1’i taşıyıcı
• Hemoglobinopatiler: Her 49 kisiden 1’i tasıyıcı
Toplumlarda taşıyıcılık oldukça yaygındır ve aile öyküsü bir ön belirteç değildir.


Yenidoğan taraması tek başına yeterli değildir.
Çok geç alınan sonuçlar tanı ve tedaviyi geciktirebilir.5,6
Tarama için doğum sonrasına kadar beklenmesi, yeni ebeveynlere planlama için yeterli zaman tanımamaktadır.
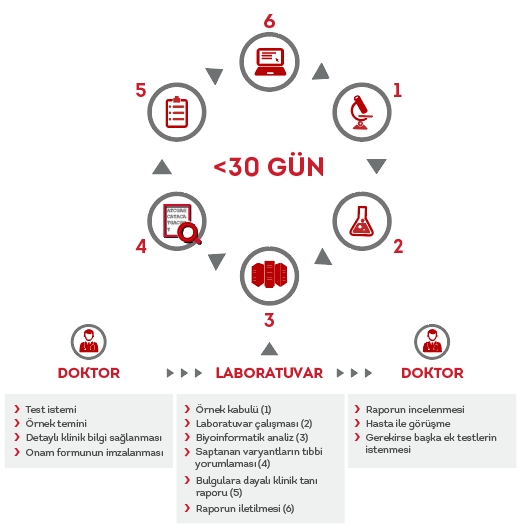
Horizon Taşıyıcılık Taraması Testi, kapsamlı ve eyleme dönüştürülebilir bilgiler sunar.
Özenle tasarlanmış paneller ile 274 farklı genetik hastalık ve sendrom için tarama yapılabilir.
Tüm paneller, ciddi ve klinik olarak önlenebilir durumları içerecek şekilde özenle tasarlanmıştır ve genişletilmiş taşıyıcı taramasına ilişkin 2015 ACMG/ACOG/NSGC/PQF/SMFM ortak bildirisine uygundur.7,8

Horizon, risk altındaki sessiz SMA taşıyıcılarını tespit etme konusunda geleneksel taramanın ötesine geçiyor.
Geleneksel SMA taramaları yalnızca sağlıklı SMN1 kopyalarının toplam sayısını hesaplar.11 Bununla birlikte, ACOG’un belirttiği gibi, sessiz taşıyıcılarda iki sağlıklı SMN1 kopyası bulunmakla birlikte kopyaların ikisi de aynı kromozomdadır.12

Geleneksel SMA taramasından farklı olarak Horizon, aynı kromozom üzerinde iki sağlıklı SMN1 kopyasının bulunmasıyla ilişkilendirilen bir “tek nükleotid polimorfizmini” (SNP) inceler. Horizon, kopya sayısına ilave olarak bu SNP’i de analiz ederek, artmış sessiz taşıyıcı olma riskini de tarayabilir.

Geleneksel testler pek çok CF taşıyıcısını gözden kaçırmaktadır.
Horizon Taşıyıcılık Taraması Testi, CFTR genindeki ekzonların tamamını dizilemektedir. Buna karşılık, geleneksel CF taramaları daha az varyantı hedefleyen bir analiz kullanır; bu da CF’ye neden olduğu bilinen varyantların çoğunu gözden kaçıracakları anlamına gelir.4

Horizon, hemoglobinopatilere yönelik kan testlerini tamamlamaktadır.
Tek basına kan sayımı ve elektroforez testi, Horizon tarafından tespit edilen alfa hemoglobinopati sessiz taşıyıcılarının %90’ını ve beta hemoglobinopati sessiz taşıyıcılarının %6’sını gözden kaçırabilir. Horizon gibi DNA tabanlı bir taramanın eklenmesi, net varyantı tanımlayarak hızlı ve kapsamlı hemoglobinopati sonuçları sunar. Horizon sonuçları, doğum öncesi doğrulayıcı tanıyı veya PGT’yi desteklemektedir.4

Horizon, rutin taramalardan daha doğru bir Frajil X risk değerlendirmesi sağlar.
Geleneksel taramalar yalnızca CGG tekrarlarının sayısını bildirirken, Horizon CGG tekrarları içindeki AGG kesintilerini de analiz eder.

Sizi ve hastalarınızı desteklemeye yönelik basit ve özelleştirilmiş kaynaklar:

Referanslar:
- Bulaklak and Gersbach. Nat Commun. 2020:11, 5820.
- American College of Obstetricians and Gynecologists, Committee Opinion # 690, March 2017.
- Archibald et al. Genet Med. 2018;20:513-523.
- Westemeyer et al. Genet Med. 2020;22(8):1320-28.
- https://www.babysfirsttest.org/. Accessed April 2020.
- Wilcken. N Engl J Med. 2008;358(6):647.
- Joint statement was a collaboration with the American College of Medical Genetics (ACMG), the American College of Obstetricians and Gynecologists (ACOG), the National Society of Genetic Counselors (NSGC), the Perinatal Quality Foundation (PQF), and the Society for Maternal-Fetal Medicine (SMFM).
- Edwards et al. Obstet Gynecol. 2015;125(3):653–62.
- Horizon 14 includes Horizon 4 and the following conditions: alpha-thalassemia, beta-hemoglo binopathies, Canavan disease, familial dysautonomia, galactosemia, Gaucher disease, medium chain acyl-CoA dehydrogenase deficiency (MCAD), autosomal recessive polycystic kidney disease (PKD), Smith-Lemli-Opitz syndrome, and Tay-Sachs.
- Spectrum Advantage disclaimer: Spectrum PGT-M and PGT-A must be performed within one year of Horizon screening results. Shipping and batching fees apply. Promotional price good for one test run and not valid if patient chooses to file insurance. Restrictions apply. Both male and female must have completed a Horizon panel with 4 or more conditions. Prior carrier screening/genetic testing identifying positive risk for a disorder voids special pricing.
- McAndrew et al. Am J Hum Genet. 1997;60(6):1411-1422.
- American College of Obstetricians and Gynecologists, Committee Opinion # 691, March 2017.
- Watson et al. Genet Med. 2004;6:387–391.
- Nolin et al. Am J Hum Genet. 2003;72(2):454-464.